Наверняка многие сталкивались с тем, что решать задачи по физической химии далеко не просто. Основная проблема, как мне кажется, заключается в следующем – эти задачи нельзя решить, просто записав формулу и подставив в нее нужные цифры. Нужно хорошо понимать сущность явления, на котором построена задача, поскольку в зависимости от того, какие компоненты и каком количестве находятся в системе, при каких условиях проводится процесс, формулы, описывающие данное явление, могут существенно изменяться.
Например, нужно рассчитать температуру замерзания водного раствора. Если растворенное вещество – неэлектролит, и концентрация его в растворе невелика, то тут все просто. Рассчитываем понижение температуры кристаллизации по закону Рауля:
ΔТзам = Кm,
где К – криоскопическая константа воды, m – моляльность раствора.
Однако, если у нас раствор электролита (любой концентрации), то нужно уже использовать формулу:
ΔТзам = iКm,
где i – изотонический коэффициент, который характеризует способность веществ распадаться на ионы. Изотонический коэффициент связан со степенью диссоциации α:
i = 1 + α(n–1), (n – число ионов в соединении)
которую для слабых электролитов можно рассчитать по закону разбавления Оствальда:
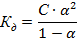
Для этого надо поискать в справочнике константу диссоциации соответствующего соединения. Если она окажется сильно меньше единицы, то α можно рассчитать по упрощенному уравнению:
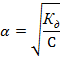
А если порядка 10–2 или больше, то придется решать квадратное уравнение.
Уже утомились, да? А мы еще не дошли до сильных электролитов. Там для оценки изотонического коэффициента нужно рассчитать ионную силу раствора:
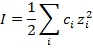
и ионные коэффициенты активности по формулам:
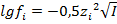 — для разбавленных растворов,
— для разбавленных растворов,
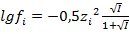 — для концентрированных растворов.
— для концентрированных растворов.
Однако, есть и хорошие новости – коэффициенты активности ионов при различных значениях ионной силы можно найти в справочниках.
Вообще, будьте готовы к тому, что справочные данные придется искать очень часто: термодинамические параметры, константы диссоциации, произведения растворимости, значения стандартных электродных потенциалов и т.д.
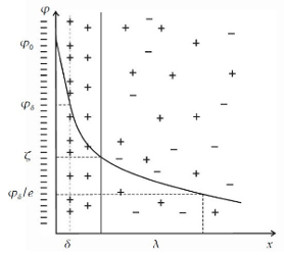
Причем, значения некоторых величин приводятся не в виде табличных данных, а в виде графической зависимости. Например, коэффициенты активности реальных газов, приходится определять вот по такой диаграмме.
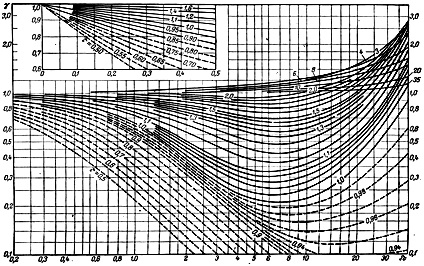
Дело, в принципе, не сложное, но требует усидчивости и внимания.
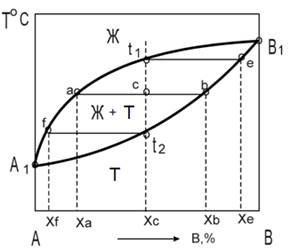
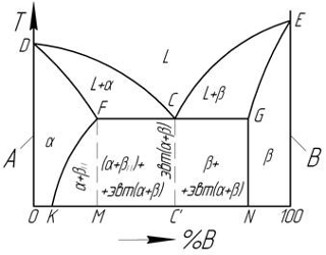
Уметь работать с диаграммами необходимо также в целом классе задач на расчет равновесного состава и относительного количества сосуществующих фаз.
Здесь используется правило рычага: отношение количеств твердой и жидкой фазы обратно пропорционально отношению отрезков, на которые делит данная фигуративная точка (с) ноду (отрезок ab). Это простейший пример. И диаграммы, и вопросы по ним весьма разнообразны.
Что касается задач по коллоидной химии, то там гораздо чаще приходится строить собственные графики. Предмет коллоидной химии – явления, происходящие на границе раздела фаз, причем, саму поверхность раздела очень сложно обозначить и практически невозможно непосредственно определить ее физические свойства. Поэтому большинство параметров, относящихся к поверхностным процессам, не рассчитывают численно, а определяют графически из экспериментальных данных для определенной системы в конкретных условиях.
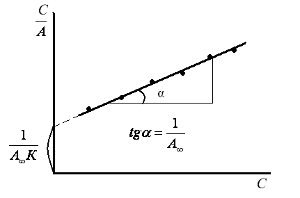 Очень распространенной задачей на эту тему является определение констант в изотерме адсорбции Ленгмюра.
Очень распространенной задачей на эту тему является определение констант в изотерме адсорбции Ленгмюра.
Исходное уравнение
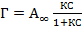 приводится к линейному виду
приводится к линейному виду
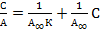 Строится график в соответствующих координатах, по которому определяется константа адсорбции К и предельная адсорбция А∞, используя значение которой можно рассчитать удельную поверхность сорбента. Графически также определяют молекулярную массу полимеров (по данным измерения вязкости растворов и уравнению Марка-Хаувинка), молекулярную массу и число молекул в мицеллах (по данным осмометрии).
Строится график в соответствующих координатах, по которому определяется константа адсорбции К и предельная адсорбция А∞, используя значение которой можно рассчитать удельную поверхность сорбента. Графически также определяют молекулярную массу полимеров (по данным измерения вязкости растворов и уравнению Марка-Хаувинка), молекулярную массу и число молекул в мицеллах (по данным осмометрии).
 Но самым изящным примером определения поверхностных характеристик образца путем измерения его макроскопических свойств и последующих графических преобразований является, на мой взгляд, седиментационный анализ. Представьте себе, только с помощью весов, линейки и секундомера можно определить, каково распределение частиц по размерам в данном образце! Причем, с довольно высокой точностью.
Но самым изящным примером определения поверхностных характеристик образца путем измерения его макроскопических свойств и последующих графических преобразований является, на мой взгляд, седиментационный анализ. Представьте себе, только с помощью весов, линейки и секундомера можно определить, каково распределение частиц по размерам в данном образце! Причем, с довольно высокой точностью.
Эксперимент предельно прост, продолжительность зависит от дисперсности образца.
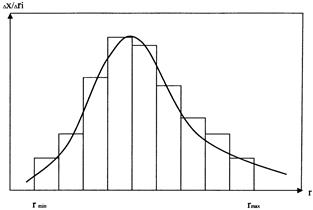
Фиксируется масса осадка в зависимости от времени, полученная кривая графически дифференцируется. Далее путем несложных математических преобразований, в основе которых лежит уравнение Стокса, получаем дифференциальную кривую распределения частиц по размерам.
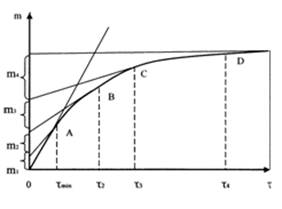 →
→
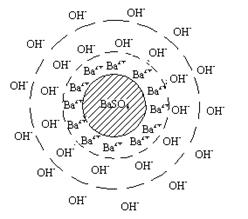 Нельзя не упомянуть также часто встречающуюся задачу по написанию формулы мицеллы золя.
Нельзя не упомянуть также часто встречающуюся задачу по написанию формулы мицеллы золя.
Золи обычно получают методом химической конденсации по реакции осаждения:
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O.
Заряд частицы золя определяется ионами, входящими в состав агрегата и находящимися в растворе в избытке. В данном случае, золь получен при избытке гидроксида бария.
Формула мицеллы будет выглядеть следующим образом:
{m[BaSO4] n Ba2+ ∙ (2n-x) OH–}x+ x OH–.
К сожалению, в небольшой статье просто невозможно даже кратко упомянуть все типы задач по физической и коллоидной химии. Для тех, кто хочет углубить свои знания по этим предметам, рекомендуем следующую литературу.
- Киселева Е.В., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии Высшая школа. 1976.
- Еремин В.В., Каргов С.И., Успенская И.А., Кузьменко Н.Е., Лунин В.В. Основы физической химии. Теория и задачи. Экзамен. 2005.
- Е. И. Тарун, П. А. Киселев, С. Б. Бокуть Сборник задач по физической и коллоидной химии. Минск. 2012.
- Цыренова С.Б., Чебунина Е.И., Балдынова Ф.П. Руководство к решению примеров и задач по коллоидной химии. Издательство ВСГТУ. 2000.
Смотрите также:
- Решение задач по общей химии
- Решение задач по органической химии
- Решение задач по аналитической химии
- Изучение биоорганической химии. Обзор
Решение задач по физической и коллоидной химии на заказ
Помните, что Вы всегда можете обратиться за помощью по химии к Решателю!