
| Срок выполнения | от 1 дня |
| Цена | от 100 руб./задача |
| Предоплата | 50 % |
| Кто будет выполнять? | преподаватель или аспирант |
ЗАКАЗАТЬ РЕШЕНИЕ ЗАДАЧ ПО ТЕРМОДИНАМИКЕ
Для успешного решения задач по данной теме необходимо знать закон сохранения энергии для термодинамики. Его же называют первым началом. Суть его состоит в том, что, когда термодинамическая система получает извне какое-то количество теплоты, то часть энергии добавляется к внутренней энергии системы, а другая возвращается в процессе совершения системой работы наружу, то есть:
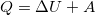 ,
,
где все величины алгебраические.
Для идеального газа изменение внутренней энергии 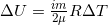 , где i = 3 – степень свободы молекул, для реального газа i зависит от строения молекулы. Так для двухатомной молекулы i = 5, для трехатомной – i = 6 и т.д.
, где i = 3 – степень свободы молекул, для реального газа i зависит от строения молекулы. Так для двухатомной молекулы i = 5, для трехатомной – i = 6 и т.д.
Работу A газ совершает только при изменении объема, т.е. 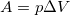 . Надо сказать, что мы получаем три случая, когда один из членов первого начала термодинамики равен 0.
. Надо сказать, что мы получаем три случая, когда один из членов первого начала термодинамики равен 0.
- Q = 0 – это адиабатический процесс, изменение состояния происходит без обмена энергией с внешней средой. A = -ΔU.
- ΔU = 0 – это изотермический процесс, так как внутренняя энергия не изменяется, а, значит не изменяется и температура. Q = A = pΔV, T = const.
- A = 0 – это изохорический процесс, так как газ не совершает работу, а значит и не меняет объема.
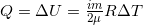 , V = const.
, V = const.
Наконец, изобарический процесс, в котором энергия расходуется на изменение внутренней энергии и на работу. 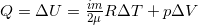 , p = const.
, p = const.
Также необходимо знать еще 4 формулы, которые помогут нам в решении задач:
- Количество теплоты, которое поглощается при нагревании или выделяется при охлаждении
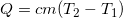 , где с – удельная теплоемкость, т.е. сколько теплоты понадобится передать или отнять у единицы массы вещества для изменения его температуры на 1o.
, где с – удельная теплоемкость, т.е. сколько теплоты понадобится передать или отнять у единицы массы вещества для изменения его температуры на 1o.
Также различают Cv – теплоемкость при постоянном объеме и Cp — теплоемкость при постоянном давлении. Причем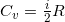 и
и 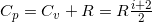 . Соответственно, удельные теплоемкости будут
. Соответственно, удельные теплоемкости будут 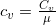 и
и 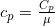 , где μ – количество вещества в молях.
, где μ – количество вещества в молях. - Количество теплоты, которое поглощается при плавление или выделяется при кристаллизации Q = λm, где λ – удельная теплота плавления.
- Количество теплоты, которое поглощается при парообразовании или выделяется при конденсации Q = rm, где r — удельная теплота парообразования.
- Количество теплоты, которое выделяется при сгорании вещества Q = qm, где q — удельная теплота сгорания.
Все эти удельные величины берутся из справочных таблиц.
В системе, которая не взаимодействует с внешней средой, т.е. в замкнутой, между элементами системы происходит исключительно теплообмен:
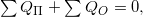
где 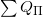 — вся полученная тепловая энергия,
— вся полученная тепловая энергия, 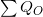 — вся отданная тепловая энергия – это закон теплового равновесия.
— вся отданная тепловая энергия – это закон теплового равновесия.
В итоге все задачи по термодинамике решаются следующим образом:
- Перевести все заданные величины в единицы СИ.
- Определить вид происходящего процесса, т.е., какие параметры остаются неизменными – T, V или P, определить, какие тела входят в замкнутую систему в теплообменных процессах и что с ними происходит.
- Выбрать из справочника необходимые табличные удельные величины или рассчитать, зная степени свободы молекул и молярные массы веществ.
- Применяя формулы, описанные выше, а так же формулы из других разделов физики, решить задачу.
Ниже рассмотрим пару примеров решения задач.
Задача 1. Закрытый сосуд содержит 14 г азота, давление p1 = 0.1 МПа, а температура t = 27oC.
Когда сосуд нагрели, давление увеличилось впятеро. Какая была конечная температура азота? Найти емкость сосуда V и количество теплоты Q, затраченное на нагревание.
Решение.
Состояние азота до нагревания 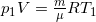 (1), после нагревания
(1), после нагревания 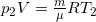 (2).
(2).
Так как сосуд закрыт, процесс изохорический, т.е. V = const и все тепло уходит на изменение внутренней энергии азота.
Найдем конечную температуру азота:
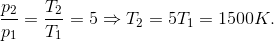
Решая совместно (1) и (2), получаем:
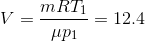 л.
л.
Количество теплоты, полученное азотом:
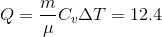 Дж,
Дж,
где 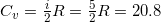 Дж/(моль · K). i = 5, т.к. молекула азота состоит из 2 атомов.
Дж/(моль · K). i = 5, т.к. молекула азота состоит из 2 атомов.
Задача 2. Сколько нужно сжечь керосина, чтобы полностью испарить 100 г воды, температура которой 20oC? К.П.Д. керосинового нагревателя η = 0,2.
Решение.
Тепловая энергия сгорания керосина Qк = qmк, с учетрм К.П.Д. Qк = ηqmк, q = 40.8 · 106 Дж/кг – для керосина. Керосин горит и отдает энергию. Вода поглощает энергию, нагреваясь от 20 до 100oС. Qн = cm(T2 — T1), с = 4.187 · 103 Дж/(кг · К) – удельная теплоемкость воды. Далее энергия расходуется на парообразование. Qп = rm, r = 2256 · 103 Дж/кг – удельная теплота парообразования воды.
Составляем уравнение теплового баланса Qк — Qн — Qп = 0:
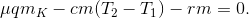
Откуда 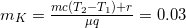 кг.
кг.
В заключение рекомендуемая литература (теоретический материал и примеры решения задач):
- Молекулярная физика и термодинамика. Исаков А.Я. (2007)
- Сивухин Д.В. и др. Сборник задач по общему курсу физики. В 5 томах. Том II. Термодинамика и молекулярная физика. (5-е изд., 2006)
- Основные принципы термодинамики. Белоконь Н.И. (1968)
Решение термодинамики на заказ
Статья написана нашим специалистом по термодинамике, гидравлике и теплотехнике. Он также выполняет заказы по решению задач. Заказать работу можно через нашу форму на сайте.