| Срок выполнения | от 1 дня |
| Цена | от 100 руб./задача |
| Предоплата | 50 % |
| Кто будет выполнять? | преподаватель или аспирант |
УЗНАТЬ СТОИМОСТЬ РАБОТЫ ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Кем бы вы ни стали, вы все равно
будете заниматься аналитикой
(Зав. каф. аналитической химии
хим. факультета СПбГУ,
д.х.н., проф. Л.Н. Москвин)
Да, можно годами не вспоминать математическую формулировку первого начала термодинамики, если вы не занимаетесь теоретическими расчетами. Можно забыть все именные реакции из курса органики, если вы занимаетесь, к примеру, синтезом неорганических сорбентов. Но если вы имеете дело с реальными химическими процессами, будь то эксперимент в лаборатории или химическое производство, то вы всегда будете заниматься аналитикой.

Аналитика – это контроль качества в самом широком смысле слова, она отвечает на вопрос, насколько хорошо у вас получилось выполнить поставленную задачу. Поэтому могу сказать с полной уверенностью, если ваша деятельность будет связана с химией, вам точно пригодится умение решать задачи по аналитической химии.
Задачи в курсе аналитической химии обычно связаны с методами количественного анализа. Эти методы можно разделить на две группы:
| Методы количественного анализа | ||||
| ↙ | ↘ | |||
| Химические методы анализа | Физико-химические методы анализа (ФХМА) | |||
| ↓ | ↓ | ↙ | ↓ | ↘ |
| Титриметрия | Гравиметрия | Оптические методы |
Электрохимические методы |
Хроматография |
Принципиальная разница между этими группами методов заключается в том, что в химических методах мы получаем значение аналитического сигнала (массу осадка или количество титранта), по которому, используя только закон эквивалентов, можно сразу вычислить концентрацию определяемого вещества. В ФХМА в качестве аналитического сигнала выступает какое-либо физическое свойство вещества или системы (изменение интенсивности проходящего света, ЭДС электрохимической ячейки, электропроводность раствора и т.д.), связать которое с концентрацией определяемого вещества – отдельная проблема.
Рассмотрим типичные расчеты в задачах по аналитической химии.
Базовые расчеты
Задачи на определение концентрации растворов, расчет навески для приготовления нужной концентрации раствора, пересчет между различными способами выражения концентраций.
Сколько граммов Na2S2O3 · 5H2O следует взять для приготовления 500 см3 0,1Н раствора?
Самое главное при решении подобных задач – четко знать, что такое молярность, нормальность, массовая доля, титр, титр по определяемому веществу, уметь рассчитывать молярную массу эквивалента. И не забывать включать логику. Все. Часто в методичках и пособиях приводят формулы для расчета концентраций для каждого конкретного случая – тогда вообще замечательно, просто подставляем нужные цифры. Если нет – выводим сами или решаем по действиям, кому как больше нравится. Освоить такие расчеты очень важно, поскольку они входят абсолютно во все задачи по аналитике.
Расчеты по химическим методам анализа
1. Титриметрия
 Вычислить нормальность раствора HCl, если на титрование 20 см3 его израсходовано 19,2 см3 0,1Н раствора NaOH.
Вычислить нормальность раствора HCl, если на титрование 20 см3 его израсходовано 19,2 см3 0,1Н раствора NaOH.
Здесь первое, что нужно сделать – записать уравнение реакции:
HCl + KOH → KCl + H2O
Потом вступает в силу закон эквивалентов:
Vв-ва ∙ Nв-ва = Vтитранта ∙ Nтитранта
Для прямого титрования получаем значение концентрации вещества сразу, для обратного титрования и титрования заместителя придется разбить процесс на этапы и немного модифицировать формулу.
Что важно, для всех видов титрования (кислотно-основного, осадительного, комплексометрического, окислительно-восстановительного) расчеты абсолютно аналогичны. Единственное, следует помнить, что число эквивалентности для веществ, участвующих в окислительно-восстановительных реакциях, определяется числом электронов, принимающих участие в реакции.
2. Гравиметрия
 При гравиметрическом определении фосфора в анализируемом образце фосфата получили массу гравиметрической формы Mg2P2O7, равную 0,4895г. Рассчитайте содержание фосфора в образце в пересчете на Р2О5.
При гравиметрическом определении фосфора в анализируемом образце фосфата получили массу гравиметрической формы Mg2P2O7, равную 0,4895г. Рассчитайте содержание фосфора в образце в пересчете на Р2О5.
Опять же пишем уравнение реакции, можно просто схему:
Р2О5 → Mg2P2O7
Определяем гравиметрический фактор, как отношение молекулярной массы определяемого вещества к молекулярной массе гравиметрической формы, учитывая стехиометрические коэффициенты в уравнении. Далее рассчитываем массу вещества по формуле:
m(Х) = F ∙ m(ГФ).
Расчеты по ФХМА
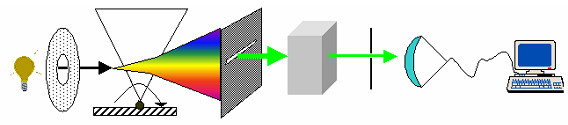
Для определения концентрации анализируемого вещества по экспериментальным данным используется несколько методик.
1. Рассчетные
- прямые методы. Значение аналитического сигнала (Ах) сразу пересчитывается в концентрацию Сх.
Сх = f(Aх).
Формулы пересчета специфичны для каждого метода.
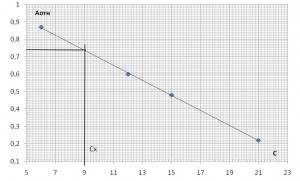
- метод добавок. Снимается значение Ах, затем к исследуемому образцу прибавляется аликвота раствора с известной концентрацией определяемого компонента Сст.
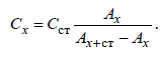
- метод одного стандарта. Фиксируются значения аналитического сигнала стандартного раствора Аст и исследуемого Ах.
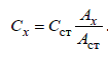
2. Градуировочный график
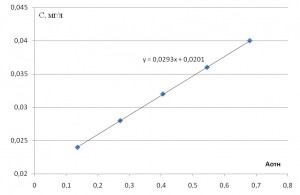
Измеряются значения аналитического сигнала для нескольких стандартных растворов, строится градуировочный график в координатах Сст – Aст, как правило, линейный. Затем измеряется Ах и по графику определяется значение концентрации. Естественно, график лучше строить в Excel, причем, в координатах Aст – Сст, тогда по уравнению линии тренда можно сразу рассчитать Сх без дополнительных построений и счета клеточек на миллиметровке.
3. Титрование
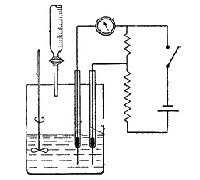 Многие электрохимические методы анализа (кондуктометрия, амперометрия, кулонометрия, потенциометрия) проводят в режиме титрования – в систему постепенно добавляется (или генерируется внутри системы) титрант, одновременно фиксируется изменение аналитического сигнала. На выходе получается набор данных, по которым нужно построить кривую титрования и определить конечную точку титрования (КТТ).
Многие электрохимические методы анализа (кондуктометрия, амперометрия, кулонометрия, потенциометрия) проводят в режиме титрования – в систему постепенно добавляется (или генерируется внутри системы) титрант, одновременно фиксируется изменение аналитического сигнала. На выходе получается набор данных, по которым нужно построить кривую титрования и определить конечную точку титрования (КТТ).
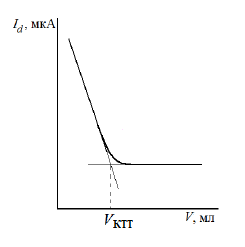
В случае кондуктометрического, амперометрического, кулонометрического титрования это можно сделать по исходной (интегральной) кривой титрования.
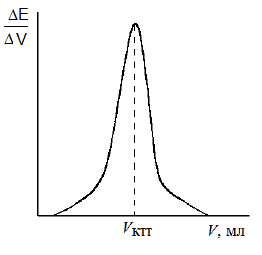
А в случае потенциометрического титрования лучше построить дифференциальную кривую.
Хочется отметить, что большинство способов определения концентрации в ФХМА универсальны, т.е. если вы рассчитываете Сх по градуировочному графику, то абсолютно не важно, используете ли вы данные фотометрического, люминисцентного или потенциометрического анализа. Исключение – прямые методы.
Условия задач по ФХМА могут выглядеть очень громоздкими из-за детального описания этапов приготовления исследуемого раствора (растворение навески, разбавление, отбор аликвот). В таких случаях нужно сначала определить концентрацию по одной из предложенных методик, а потом учесть все разбавления, используя навыки, полученные при решении базовых задач.
В заключение, порекомендуем следующие пособия, там есть и теоретический материал, и подробные примеры решения задач:
- Харитонов Ю.А., Григорьева В.Ю. Примеры и задачи по аналитической химии. ГОЭТАР-Медиа, 2008.
- Сборник вопросов и задач по аналитической химии. под ред. В. П. Васильева. Высш. школа», 1976.
Решение аналитической химии на заказ
Если у вас возникли проблемы с решением задач, вы всегда можете обратиться за консультацией к нам. Наши специалисты могут подробно решить вам задания по химии любой сложности. Заказать решение задач по химии можно, не покидая нашего сайта, на странице решения задач.